Vår forskning
Få medicinska uppfinningar har påverkat och räddat så många liv som vaccin mot infektionssjukdomar. De utmaningar vi står inför idag med att utveckla nya effektiva vacciner mot flera av världens allvarligaste infektionssjukdomar (tex HIV-1/AIDS, malaria, tuberkulos), nya pandemier samt att designa terapeutiska vacciner mot tumörer och/eller allergier kräver en mycket mer ingående förståelse av de mekanismer som styr vaccinsvar.
Utvecklingen av nya vacciner baserade på nanopartiklar eller mRNA är en ny era inom vaccinologi. Effekten av dessa nya vaccintekniker är på sikt mycket stor både när det gäller säkerhet och kostnadsminskning. Ändå saknas en hel del grundläggande förståelse kring interaktionerna mellan vaccin och immunfunktionerna som påverkar kvaliteten på vaccinsvaret.
Vår grupp har haft ett långsiktigt fokus på centrala frågor inom vaccinologi relaterade till både de första händelserna direkt efter vaccinadministrering samt till hur långvarig högkvalitativ immuniteten skapas. Våra studier berör hur vaccinantigen, adjuvans och mRNA-vacciner interagerar med olika cellpopulationer i kroppen och vad som händer vid injektionsstället och sedan hur vidare spridning i kroppen sker. Eftersom induktion av varaktiga och höga nivåer av neutraliserande antikroppar är en förutsättning för att förhindra flera allvarliga infektioner handlar flera av våra projekt om utvecklingen av B-cellssvar. Dessa projekt fokuserar på hela uppbyggnaden av immunitet från reaktioner i lymfknutor där B cellerna väljs ut till stimulering av hållbara och höga nivåer av antikroppar med bred specificitet.
Med en bättre förståelse om hur immunsystemet interagerar med vacciner skulle vi vara bättre positionerade för att välja ut vaccin som kan ge starkare immunitet, användas i lägre eller färre doser och som inte ger biverkningar.
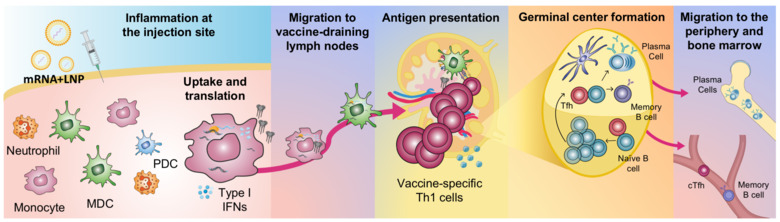
Pågående projekt
- Hur funktioner av det tidiga ospecifika immunförsvaret t.ex. cellaktivering och antigenproduktion efter administration av mRNA-vaccin påverkar kvaliteten på de vaccinspecifika svaren.
- Hur antigener som uttrycks på nanopartikelvaccin kan öka vaccinspecifik B-cells- och T-cellsimmunitet.
- Korrelationen mellan den tidiga immunprofilen och induktion av högkvalitativa och hållbara antikroppssvar efter vaccination i människor.
- Hur olika nya adjuvans stimulerar cellpopulationer och kan rikta in och förbättra immuniteten för att kontrollera olika infektioner eller tumörer.



