Mer om vår forskning på engelska sidan.
Framförallt är vi intresserade av hur samspelet mellan neuron och glia celler påverkar utvecklandet och underhållet av neuronala nätverk. Genom att använda oss av cellulär omprogrammering skapar vi individspecifika cellulära modeller, bestående av neuron och glia celler, från individer med en kronisk hjärnsjukdom och matchade friska kontroller. Dessa modeller kan sedan studeras med exempelvis genetisk manipulation och läkemedelsscreening.
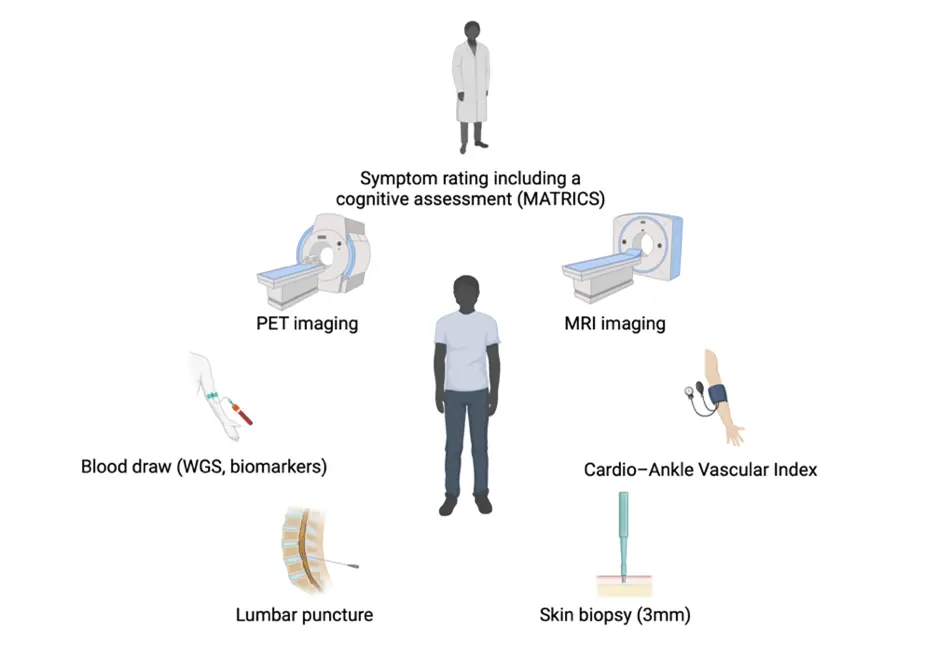
Vår forskning bedrivs i tätt samarbete med hälso- och sjukvården och innefattar storskalig och systematisk insamling av kliniska data och biologiskt material från exempelvis individer med schizofreni eller bipolärt syndrom.
Genom samordnad och individspecifik insamling av data kan vi också i samarbetsprojekt länka våra fynd i cellkulturer till in vivo markörer såsom exempelvis analyser av cerebrospinalvätska eller positronemissionstomografi data.
Gruppmedlemmar
- Sanna Bruno, Anknuten till forskning
- Sara Holmqvist, Anknuten till forskning
- Sravan Goparaju, Forskare
- Jessica Gracias, PhD student
- Henrik Gregemark, Anknuten till forskning
- Neda Khanlarkani, Postdoktor
- Charlotta Leandersson, Anknuten till forskning
- Susmita Malwade, Doktorand
- Ana Oliveira, Postdoktor
- Funda Orhan, Forskargruppsledare
- Samudyata Samudyata, Postdoktor
- Ruth Schlissel, Anknuten till forskning
Nyheter
 Foto: iStock
Foto: iStockFunda Orhan vill förstå vad som orsakar schizofreni
Läs artikeln på Hjärnfondens webbplats, publicerad den 29 mars 2019
 Foto: Creative Commons CC0
Foto: Creative Commons CC0Stöd vår forskning
Gåvor till FyFa, både stora och små, betyder mycket för forskningens framgångar. Du kan välja att ge din gåva via betallösningen Swish, bankgiro eller kortbetalning.