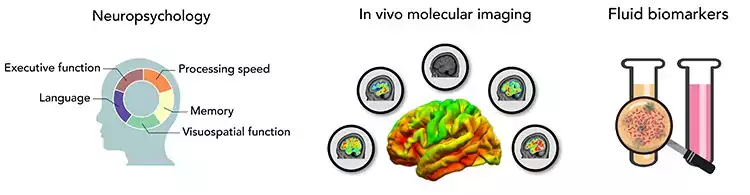
Proteinopatier karaktäriseras av inlagring i hjärnan av olika proteiner vilket är vanligt förekommande vid neurodegenerativa hjärnsjukdomar och används som ett paraplybegrepp för sjukdomar som ofta leder till demens. Proteinopatier karakteriseras av ackumulering eller förändring i funktion av specifika proteiner i eller utanför nervcellerna i hjärnans parenkym och uppvisar olika regional distribution i hjärnan.
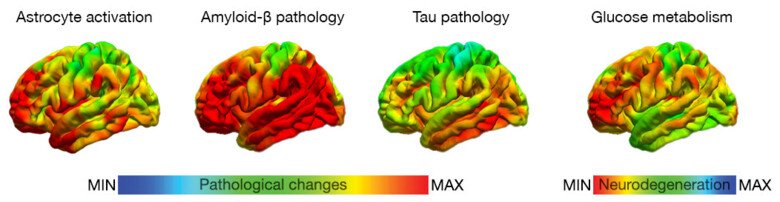
Alzheimers sjukdom (AD), den vanligaste demenssjukdomen, karakteriseras av förekomsten av amyloid-β (Aβ) plack och hyperfosforylerade tau proteinnystan. Dessutom, bidrar ett antal andra processer, såsom inflammatoriska reaktioner med aktiveringen av astrocyter och mikroglia samt neurovaskulära faktorer, vilket resulterar i synaptisk dysfunktion, kognitiv påverkan och hjärnatrofi. Många s.k. icke-AD tauopatier, karakteriseras såväl av inlagring av patologiska tau proteinnystan, som andra komplexa komponenter av proteinavlagringar.
AD karaktäriseras av en lång presymptomatisk period, där neuropatologiska förändringar kan starta i hjärnan årtionden innan kliniska symptom uppstår . Dessa processer kan studeras i hjärnan med användandet av hjärnavbildningstekniker, såsom positron emissions tomografi (PET) och magnetisk resonans tomografi (MRI), och användas som tidiga imaging biomarkörer.

Vår forskning har en translationellt inrikting där vi utnyttjar molekylära hjärnavbildningstekniker både in vitro och in vivo studier. Vårt mål är att karakterisera neurodegenerativa sjukdomars komplexa patofysiologiska egenskaper med ett starkt fokus på AD, men även andra proteinopatier. Detta i syfte att utveckla nya tidiga diagnostiska markörer och nya målorgan för läkemedelskandidater för tidig intervention i sjukdomsprocesser vid AD och andra demenssjukdomar.
Samarbeten
Vi har ett omfattande nätverk av samarbeten dels inom vår egen institution (NVS), med andra institutioner vid KI samt dels med olika forskargrupper vid andra universitet i Sverige, inklusive Uppsala, Göteborg och Stockholm. Vi bedriver även ett flertal internationella samarbeten med forskningsgrupper vid utländska universitet såsom, Helsinfors universitet, Åbo universitet, Manchester universitet, Indiana universitet, Denver universitet, Geneve universitet, Harvard Medical School, La Pitie Salpetriere-Charles Foix hospital, Amsterdam universitet, McGill universitet and Universitat Autónoma de Barcelona, Tohoku universitet, Japan, National Institute of Radiological Sciences, Chiba, Japan.
Forskningskonsortier
- Stiftelsen för Strategisk Forskning (SSF): “Nya biomarkörer vid tidig diagnos och behandling av Alzheimers sjukdom”. Agneta Nordberg (PI), Eric Westman, Christer Halldin, Karolinska Institutet (KI), Hans Ågren, Kungliga Tekniksa Högskolan (KTH), Bengt Långström, Uppsala Universitet (UU)
- Vetenskapsrådet (VR) Demens Plattformen: “Proteinopatier vid neurodegenerativa sjukdomar –nya imaging biomarkörer and målorgan för nya läkemedel”, Agneta Nordberg (PI), Christer Halldin , Per Svenningsson (KI), Hans Ågren (KTH), Bengt Långström (UU)
- Innovative Medicines Initiative (IMI) AMYPAD, “Amyloid imaging- att förhindra Alzheimers sjukdom”. Projektkoordinator Frederik Barkhof, Amsterdam universitet, (PI) Stockholm (KI) Agneta Nordberg.
Forskningsstöd
Vi tackar särskilt följande bidragsgivare för det stöd de ger eller tidigare har givit vår forskning:
- Vetenskapsrådet (VR)
- Stiftelsen för Strategisk Forskning (SSF)
- Hjärnfonden
- Alzheimerfonden
- Stockholm Läns Landstings och Karolinska Institutets regionala överenskommelse om utbildning av läkare och klinisk forskning (ALF)
- Karolinska institutets Stiftelser
- Demensfonden
- Stiftelsen för Gamla Tjänarinnor
- Gun and Bertil Stohnes Stiftelse
- Stiftelsen Sigurd and Elsa Goljes Minne
- Loo and Hans Ostermans Stiftelse
- Tore Nilson Stiftelse
- Stiftelsen för Ålderssjukdomar vid Karolinska Institutet
- KTH-SLL anslag
- Axel Linders Stiftelse
- Åke Wibergs Stiftelse
- The EU FW7 large-scale integrating project INMIND
(http://www.unimuenster.de/INMIND) - JPND
- Innovative medicine initiative (IMI) Amypad