Vår forskning
Vår vision är att förklara hur epigenomet integrerar instruktioner från genetiska faktorer och livsstilsfaktorer som gör immunceller aggressiva och hjärnceller sårbara hos personer som drabbats av multipel skleros.
Vårt mål är att bättre förstå sjukdomens etiologi och att förbättra sjukdomshanteringen genom nya individanpassade behandlingar och mer specifika och känsliga biomarkörer.
Vi är en mycket samarbetsvillig internationell grupp som strävar efter att gå i spetsen för translationell epigenetisk forskning. Vi strävar efter att besvara relevanta kliniska frågor genom att kombinera djup molekylär profilering i unika kliniska material med hjälp av banbrytande verktyg och avancerade funktionella experimentella modeller.

Epigenetiska ursprung och mekanismer för neuroinflammation
Epigenetik består av stabila ändringar av genuttryck nedärvda från en cellgeneration till nästa utan förändring i DNA-sekvensen (den genetiska koden). Det skapar ytterligare och mer flexibla nivåer av reglering utöver och epigenetiska förändringar kan formas genom miljön.
Vi studerar hur epigenetiska mekanismer påverkar neuroinflammation hos människor och experimentella modeller. På grund av dess stabilitet kan epigenetiska modifieringar ge robusta och stabila biomarkörer för sjukdomsaktivitet. Med hjälp av reversibilitet kan det vara möjligt att ändra ett ogynnsamt epigenetiskt tillstånd och behandla sjukdomen.
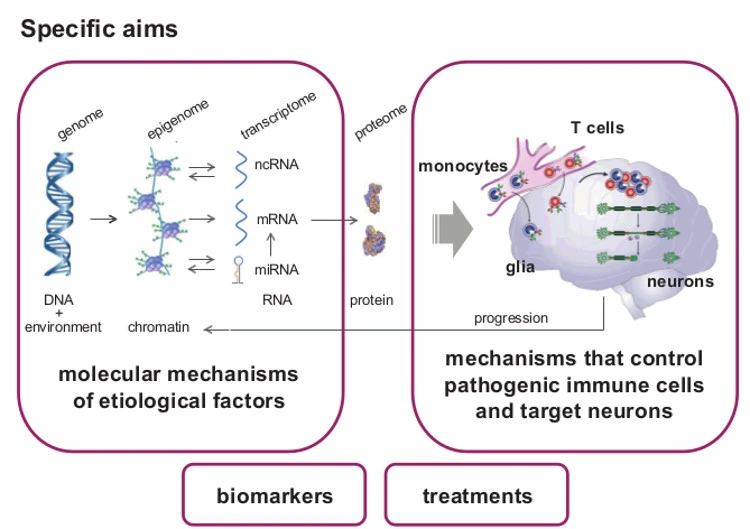
Vi strävar efter att karaktärisera epigenetiska mekanismer som underligger neuroinflammation för att bättre förstå kroniska inflammatoriska sjukdomar och att utveckla nya behandlingar och biomarkörer. Epigenetiska förändringar uppstår som svar på inre och yttre miljö och fastställer tidpunkt och plats för genuttryck. Detta uppnås främst genom DNA- metylering, histonändringar, aktivering av nukleära faktorer och icke-kodande RNA vilka formar 3D-strukturen av genetiskt material.
Vårt fokus ligger på DNA-metylering och mikro-RNA. Vi undersöker (i) epigenetiskt arv av inflammation, (ii) epigenetiska landskap av inflammatoriska celler och inflammerad vävnad och (iii) genetiska och miljömässiga faktorer som styr epigenetiska tillstånd.
Forskningsprojekt
- Epigenetic mechanisms of heritable risk factors
- Epigenetic landscape of inflammatory cells
- A role of micro RNAs in neuroinflammation
- DNA methylation of multiple sclerosis lesions
- DNA methylation of cell mediators in multiple sclerosis and animal models
- Factors that control epigenetic states
- Vitamin D induced epigenetic changes
- Genetic control of epigenetic states


